energía de activación y reacción :)
Energía de activación y reacción.
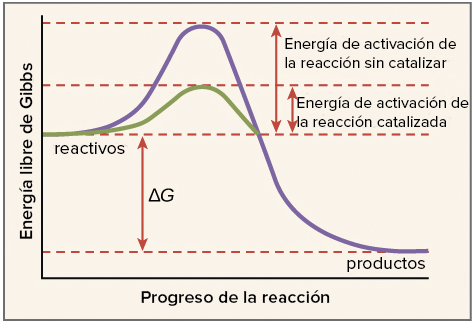
La energía de activación,
como ya se indicó, suele utilizarse para denominar energía mínima necesaria
para que se produzca una reacción química. Para que ocurra una reacción entre
dos moléculas, estas deben colisionar en la orientan correcta y poseer una
cantidad de energía mínima
Energía de reacción
Reacción
química se absorbe o desprende energia (normalmente como olur). Esto se debe a
que al romperse y formarse enlaces se absorbe y se desprende energia
respectivamente. Equilibrio dinámico es un equilibrio químico, donde dos
reacciones reversibles a la misma velocidad, en ambos sentidos, manteniéndose
la concentrada de reactivos y productos, constante en el tiempo. Dicho de otra
manera el equilibrio dinámico, dos reacciones opuestas ocurren a la misma
velocidad
Un
ejemplo práctico y sencillo seria colocar un balde de agua en un espacio pequeño
y cerrado. El agua del balde comienza a evaporar, hasta saturar el aire al
lugar. Una vez saturado el ambiente, se sigue evaporando algo de agua la
humedad ambiental choca contra la superficie del balde y se condensa
Las reacciones que intervienen en el equilibrio dinámico denominan reacción
directa e inversa. Si la reacción directa ocurre en un recipiente cerrado, la
concentración de los productos alcanza un cierto punto, comienza a producirse
la reacción inversa, hasta alcanzar el equilibrio dinámico químico.
Los reactivos continúan su reacción directa, alimentados por la reacción
in-versa, que ocurre a la misma velocidad. El estado de equilibrio se indica
colocando una doble flecha en la reacción
Se dice que un equilibrio es homogéneo cuando sus componentes se encuentran
todos en la misma fan o estado.
VÍDEO:
Comentarios
Publicar un comentario